نصيحة 1: لماذا هي الذرة محايدة؟
نصيحة 1: لماذا هي الذرة محايدة؟
ذرة يتكون من نواة والإلكترونات. في صميم تقع تقريبا كتلة كاملة من الذرة، لكنه يأخذ سوى جزء صغير جدا من حجمه. تدور الإلكترونات حول النواة على طول المدارات الدائرية والبيضاوية، وتشكل قذيفة الإلكترون. تم تأكيد هذا الهيكل من الذرة من خلال تجارب العالم روثرفورد، الذي درس انحراف الجسيمات خلال مرور الأشعة السينية من خلال أنحف لوحات الذهب. يحمل كل إلكترون شحنة سالبة للوحدة. لماذا تكون الذرة، كما تؤكد الدراسات، محايدة؟
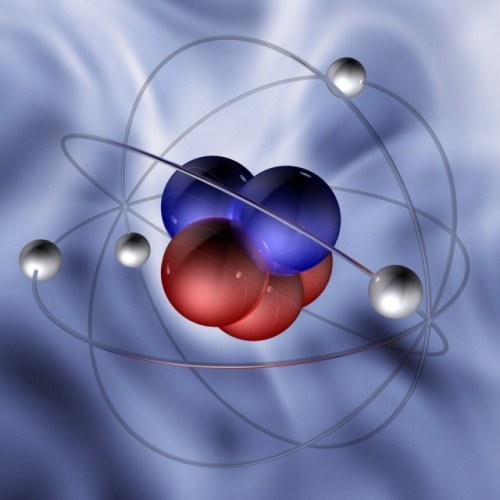
نصيحة 2: كيفية العثور على البروتونات
أتوم هو نوع من نسخة مصغرةالنظام الشمسي. فقط بدلا من الشمس في مركزها هو نواة ضخمة، وبدلا من الكواكب، والجسيمات الأولية - الإلكترونات - تدوير. الذرة محايدة كهربائيا، وبالتالي فإن مجموع الشحنة السلبية للإلكترونات يجب أن تكون متوازنة من قبل مجموع الشحنة الموجبة من نفس الحجم. يحدث هذا، لأن جوهر يتكون من الجسيمات الأولية الأخرى - البروتونات والنيوترونات. كل بروتون يحمل نفس تهمة الإلكترون، فقط مع علامة المعاكس.

تعليمات
1
لنفترض أنك على علم بظروف المشكلةمجموع شحنة موجبة س من النواة الذرية. لمعرفة عدد البروتونات N، لدينا فقط لتقسيم Q من حجم بروتون تهمة قر. (يمكن العثور عليها في كتيب الفيزياء أو الكيمياء). وهذا هو، N = Q / قبر.
2
يمكنك العثور على عدد من البروتونات في النواة باستخدامالجدول الدوري. في هذا الجدول، يتم تعيين كل عنصر محدد مكان محدد بدقة، اعتمادا على خصائصها الكيميائية. والخصائص الكيميائية، في المقام الأول، يتم تحديدها من قبل هيكل ذرة العنصر.
3
وتحتوي كل خلية من الجداول على المعلومات الضرورية عن العنصر الكيميائي، بما في ذلك الرقم التسلسلي. هنا فقط يتوافق مع عدد من البروتونات في نواة ذرة العنصر.
4
انظر إلى الجدول. العنصر رقم 11 - الصوديوم المعدني القلوي (نا). وبالتالي، في كل ذرة الصوديوم هناك 11 البروتونات. أو العنصر رقم 23 هو معدن الفاناديوم (V)، الذي يظهر ليس فقط الخصائص الأساسية ولكن أيضا الحمضية في مركباته. استنادا إلى عددها الترتيبي، يمكننا أن نستنتج: في كل ذرة الفاناديوم هناك 23 البروتونات.
5
إجراء نوع من التحقق. ومن المعروف أن الذرة محايدة كهربائيا. ولكن بما أن النيوترونات لا تحمل أي رسوم على الإطلاق، إلا أن الإلكترونات يمكنها أن توازن بين الشحنة الإيجابية الإجمالية للبروتونات الذرية. وبالتالي، يجب أن يكون هناك 11 الإلكترونات في ذرة الصوديوم، وفي ذرة الفاناديوم - 23. تحقق ما إذا كان هذا هو الحال.
6
مرة أخرى، أخذ الجدول الدوري. وتحتوي كل خلية على بيانات تبين كيفية ملء المستويات الإلكترونية للذرة من هذا العنصر. الصوديوم: اثنين من الإلكترونات على المستوى الأول، ثمانية إلكترونات في المستوى الثاني وواحدة على الثالثة (الخارجية). في المجموع، أحد عشر الإلكترونات. الفاناديوم: اثنين من الإلكترونات على المستوى الأول، ثمانية - على الثانية، أحد عشر - على الثالث واثنين - على الرابع (الخارجي). في المجموع ثلاثة وعشرين الإلكترونات. مجموع الرسوم متوازنة، الذرات محايدة كهربائيا.







